Page 6 - BOLL_SNO_18_2021_flip
P. 6
6 Periodico di informazione
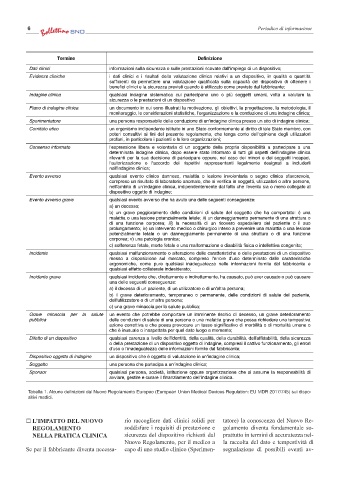
Termine Definizione
Dati clinici informazioni sulla sicurezza o sulle prestazioni ricavate dall'impiego di un dispositivo;
Evidenze cliniche i dati clinici e i risultati della valutazione clinica relativi a un dispositivo, in qualità e quantità
sufficienti da permettere una valutazione qualificata sulla capacità del dispositivo di ottenere i
benefici clinici e la sicurezza previsti quando è utilizzato come previsto dal fabbricante;
Indagine clinica qualsiasi indagine sistematica cui partecipano uno o più soggetti umani, volta a valutare la
sicurezza o le prestazioni di un dispositivo
Piano di indagine clinica un documento in cui sono illustrati la motivazione, gli obiettivi, la progettazione, la metodologia, il
monitoraggio, le considerazioni statistiche, l'organizzazione e la conduzione di una indagine clinica;
Sperimentatore una persona responsabile della conduzione di un'indagine clinica presso un sito di indagine clinica;
Comitato etico un organismo indipendente istituito in uno Stato conformemente al diritto di tale Stato membro, con
poteri consultivi ai fini del presente regolamento, che tenga conto dell'opinione degli utilizzatori
profani, in particolare i pazienti o le loro organizzazioni;
Consenso informato l'espressione libera e volontaria di un soggetto della propria disponibilità a partecipare a una
determinata indagine clinica, dopo essere stato informato di tutti gli aspetti dell'indagine clinica
rilevanti per la sua decisione di partecipare oppure, nel caso dei minori e dei soggetti incapaci,
l'autorizzazione o l'accordo dei rispettivi rappresentanti legalmente designati a includerli
nell'indagine clinica;
Evento avverso qualsiasi evento clinico dannoso, malattia o lesione involontaria o segno clinico sfavorevole,
compreso un risultato di laboratorio anomalo, che si verifica in soggetti, utilizzatori o altre persone,
nell'ambito di un'indagine clinica, indipendentemente dal fatto che l'evento sia o meno collegato al
dispositivo oggetto di indagine;
Evento avverso grave qualsiasi evento avverso che ha avuto una delle seguenti conseguenze:
a) un decesso;
b) un grave peggioramento delle condizioni di salute del soggetto che ha comportato: i) una
malattia o una lesione potenzialmente letale; ii) un danneggiamento permanente di una struttura o
di una funzione corporea; iii) la necessità di un ricovero ospedaliero del paziente o il suo
prolungamento; iv) un intervento medico o chirurgico inteso a prevenire una malattia o una lesione
potenzialmente letale o un danneggiamento permanente di una struttura o di una funzione
corporea; v) una patologia cronica;
c) sofferenza fetale, morte fetale o una malformazione o disabilità fisica o intellettiva congenita;
Incidente qualsiasi malfunzionamento o alterazione delle caratteristiche o delle prestazioni di un dispositivo
messo a disposizione sul mercato, compreso l'errore d'uso determinato dalle caratteristiche
ergonomiche, come pure qualsiasi inadeguatezza nelle informazioni fornite dal fabbricante e
qualsiasi effetto collaterale indesiderato;
Incidente grave qualsiasi incidente che, direttamente o indirettamente, ha causato, può aver causato o può causare
una delle seguenti conseguenze:
a) il decesso di un paziente, di un utilizzatore o di un'altra persona;
b) il grave deterioramento, temporaneo o permanente, delle condizioni di salute del paziente,
dell'utilizzatore o di un'altra persona;
c) una grave minaccia per la salute pubblica;
Grave minaccia per la salute un evento che potrebbe comportare un imminente rischio di decesso, un grave deterioramento
pubblica delle condizioni di salute di una persona o una malattia grave che possa richiedere una tempestiva
azione correttiva e che possa provocare un tasso significativo di morbilità o di mortalità umane o
che è inusuale o inaspettata per quel dato luogo e momento;
Difetto di un dispositivo qualsiasi carenza a livello dell'identità, della qualità, della durabilità, dell'affidabilità, della sicurezza
o della prestazione di un dispositivo oggetto di indagine, compresi il cattivo funzionamento, gli errori
d'uso o l'inadeguatezza delle informazioni fornite dal fabbricante;
Dispositivo oggetto di indagine un dispositivo che è oggetto di valutazione in un'indagine clinica;
Soggetto una persona che partecipa a un'indagine clinica;
Sponsor qualsiasi persona, società, istituzione oppure organizzazione che si assume la responsabilità di
avviare, gestire e curare il finanziamento dell'indagine clinica.
Tabella 1. Alcune definizioni dal Nuovo Regolamento Europeo (European Union Medical Devices Regulation: EU MDR 2017/745) sui dispo-
sitivi medici.
L’IMPATTO DEL NUOVO rio raccogliere dati clinici solidi per tatore) la conoscenza del Nuovo Re-
REGOLAMENTO soddisfare i requisiti di prestazione e golamento diventa fondamentale so-
NELLA PRATICA CLINICA sicurezza del dispositivo richiesti dal prattutto in termini di accuratezza nel-
Nuovo Regolamento, per il medico a la raccolta del dato e tempestività di
Se per il fabbricante diventa necessa- capo di uno studio clinico (Sperimen- segnalazione di possibili eventi av-