Page 124 - 17_Atti_SNO_2023_flip
P. 124
Proceedings SNO “LXII Congresso Nazionale SNO”
Ipereccitabilità della rete
peritumorale mediata
da glutammato, D2-G, GPC
ed infiammazione
Neuroni
Sulfasalazina
Rilascio infiammatorio
di citochine
Astrociti
PNN
Microglia
degradazione
Sistema
xc- Rilascio Sinapsi Espressione
GCP
Ricaptazione degli enzimi glioneuronali
proteolitici
del
Rilascio aberrante di glutammato glutammato Accumulo di
D2-HG
compromessa
e rilascio
Espressione
EAAT ridotta
Mutazioni Mutazioni
IDH PIK3CA
Correnti non sinaptiche evocate dall’attività neuronale
Cellule e mediate dalle giunzioni comunicanti
del glioma
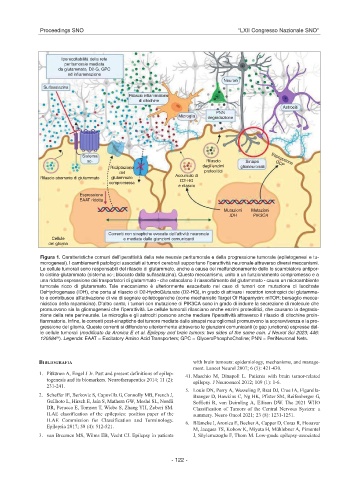
Figura 1. Caratteristiche comuni dell’iperattività della rete neurale peritumorale e della progressione tumorale (epiletogenesi e tu-
morogenesi). I cambiamenti patologici associati ai tumori cerebrali supportano l’iperattività neuronale attraverso diversi meccanismi.
Le cellule tumorali sono responsabili del rilascio di glutammato, anche a causa del malfunzionamento dello lo scambiatore antipor-
to cistina-glutammato (sistema xc-; bloccato dalla sulfasalazina). Questo meccanismo, unito a un funzionamento compromesso e a
una ridotta espressione dei trasportatori di glutammato - che ostacolano il riassorbimento del glutammato - causa un microambiente
tumorale ricco di glutammato. Tale meccanismo è ulteriormente esacerbato nel caso di tumori con mutazione di Isocitrate
DeHydrogenase (IDH), che porta al rilascio di D2-HydroGlutarate (D2-HG), in grado di attivare i recettori ionotropici del glutamma-
to e contribusce all’attivazione di vie di segnale epilettogeniche (come mechanistic Target Of Rapamycin: mTOR; bersaglio mecca-
nicistico della rapamicina). D’altro canto, i tumori con mutazione di PIK3CA sono in grado di indurre la secrezione di molecule che
promuovono sia la gliomagenesi che l’iperattività. Le cellule tumorali rilasciano anche enzimi proteolitici, che causano la degrada-
zione della rete perineurale. Le microglia e gli astrociti possono anche mediare l’iperattività attraverso il rilascio di citochine proin-
fiammatorie. Infine, le correnti post-sinaptiche del tumore mediate dalle sinapsi neurogliomali promuovono la sopravvivenza e la pro-
gressione del glioma. Queste correnti si diffondono ulteriormente attraverso le giunzioni comunicanti (o gap junctions) espresse dal-
le cellule tumorali (modificato da Aronica E et al. Epilepsy and brain tumors: two sides of the same coin. J Neurol Sci 2023; 446:
(8)
120584 ). Legenda: EAAT = Excitatory Amino Acid Transporters; GPC = GlyceroPhosphoCholine; PNN = PeriNeuronal Nets.
BIBLIOGRAFIA with brain tumours: epidemiology, mechanisms, and manage-
ment. Lancet Neurol 2007; 6 (5): 421-430.
1. Pitkänen A, Engel J Jr. Past and present definitions of epilep-
41. Maschio M, Dinapoli L. Patients with brain tumor-related
togenesis and its biomarkers. Neurotherapeutics 2014; 11 (2): epilepsy. J Neurooncol 2012; 109 (1): 1-6.
231-241.
5. Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-
2. Scheffer IE, Berkovic S, Capovilla G, Connolly MB, French J, Branger D, Hawkins C, Ng HK, Pfister SM, Reifenberger G,
Guilhoto L, Hirsch E, Jain S, Mathern GW, Moshé SL, Nordli Soffietti R, von Deimling A, Ellison DW. The 2021 WHO
DR, Perucca E, Tomson T, Wiebe S, Zhang YH, Zuberi SM. Classification of Tumors of the Central Nervous System: a
ILAE classification of the epilepsies: position paper of the summary. Neuro Oncol 2021; 23 (8): 1231-1251.
ILAE Commission for Classification and Terminology. 6. Blümcke I, Aronica E, Becker A, Capper D, Coras R, Honavar
Epilepsia 2017; 58 (4): 512-521.
M, Jacques TS, Kobow K, Miyata H, Mühlebner A, Pimentel
3. van Breemen MS, Wilms EB, Vecht CJ. Epilepsy in patients J, Söylemezoglu F, Thom M. Low-grade epilepsy-associated
- 122 -